|
|
|
疾病代碼:
|
DIS00180
|
|
建立日期: |
2009/03/02
|
|
更新日期: |
2015/01/09
|
|
作 者:
|
黃旭田
|
|
中文病名:
|
魚孢黴菌症
|
|
英文病名:
|
Ichthyophoniasis
|
|
疾病描述:
|
1.病原型別:黴菌(Fungus)
病原環境:海水及淡水(marine, freshwater)
學名:Ichthyophonus hoferi
病名(及俗名):魚孢黴菌症(Ichthyophoniasis)
最早發現者:Hofer et al.(1893)
OIE狀況:未表列(Not Listed)
病原摘要:
在病魚組織中可同時存在本病原生活史中的幾個不同型態之菌體變化,但以多核球狀體(multinucleate spherical body)或稱為合孢體最易觀察與存在;是由菌體細胞核直接分裂增加核數,細胞壁一面肥厚與增長,而發育成數十到一百個左右之多核球狀體,如果是侵害稚魚,其多核球狀體直徑大小約20-125µm,感染一年魚之病魚,直徑約40-140µm。
人畜共通:No
2.病原分類
原蟲界(Kingdom Protozoa)、肉足鞭毛亞界(Subkingdom Sarcomastigota)、Choanozoa(Phylum Choanozoa)、Mesomycetozoea綱(Class Mesomycetozoea Mendoza et al., 2001)、Ichthyophonida目(Order Ichthyophonida)、Ichthyophonus屬(Genus Ichthyophonus, Plehn & Mulsow, 1911)
命名沿革:
Ichthyosporidium gasterophilum, Caullery & Mesnil, 1905; Ichthyophonus hofesi; Plehn & Mulsow, 1911
疾病特性
目前魚孢黴菌之分類尚未完全確立,各家學者均有不同的看法,有的學者主張它較接近蟲黴科(Entomophthoraceae)、也有主張將它置於不完全菌(Imperfectica),另有人將它置於藻菌綱(Phycomycetes)之壺菌目(Chytridiales),而魚孢黴菌屬,現今有二個種,一為魚孢黴菌(Ichthyophonus hoferi)可感染多種淡水、海水及半淡鹼水養殖或野生魚類(約80~100多種),另一種為Ichthyophonus irregularis sp. nov.(Rand et al, 2000)感染黃尾錐齒鰈(yellowtail flounder, Limanda ferruginea)。一般呈慢性系統性感染及在內臟器官形成肉芽腫性病灶;而感染程度則端視環境及生理因素可加強慢性疾病之進展成為更嚴重的疾病。本病原在罹病魚體內可觀察到二種型態;最常見為球形合孢體(又稱多核球狀體),直徑由數μm至200μm,由無結構或層狀的膜包圍,內含有幾十個至幾百個小圓形核和含有PAS染色陽性之許多顆粒狀原生質,最外面具有宿主形成的結締組織膜包圍,形成白色孢囊。另一種型態則是孢囊破裂後,合孢體伸出短而粗、有時呈分枝狀之菌絲體,細胞漿移至菌絲體的前端,形成許多球狀內孢子(endospors)。
本病原(Ichthyophonus hoferi)能經口感染,以組織病理學的研究推論;從胃黏膜固有層至黏膜下層的部位是初步感染部位。當經口入侵之具厚壁合孢體,在胃黏膜上皮發芽,伸長菌絲體,侵入黏膜上皮內,並在感染部位形成菌絲體孢子,不久釋放孢子游出,進入血液循環而傳播全身,特別是血液供應充份的臟器,肝、腎、脾、心臟及鰓,最常呈現白色結節病灶。菌絲體狀孢子在各內臟器官組織也會產生多數個體,這些亦會進入血行內而被傳播或游出在臟器實質組織周圍形成集塊;再進行另一次的重覆繁殖。故推斷其感染源,可能來自被感染之魚體所釋放的孢子附於水中生物餌料或撓腳類如哲水蚤,Chatton氏(1920, R)曾報導撓腳類,如Acartia、Paracalamus、Clausocalanus會被Ichthyosporidium感染,Jepps氏(1937, R)亦提出報告推測Calanur spp.可被I. hoferi感染;Torgersen et al.等氏(2002, R)則證實撓腳類被魚孢黴菌感染後,再經由魚類吃食而侵入魚體,造成全身系統性器官感染。
至於魚孢黴菌生活史有很多研究報告,如圖一所示(摘自Chien, 1979b)
 (Chien, 1979) (Chien, 1979)
A- H:乃寄生於魚體組織內的生活史;發育期階段是由二個核與具有薄細胞壁的二核體之絲狀體孢子(A),以核的直接分裂增加核數,細胞壁一面肥厚與增長,而發育成數十到一百個左右的多核球狀體(multinucleate spherical body, B.C.D)。這時期的多核球狀體之大小,如果是稚魚期發病,其多核球狀體直徑大小約20~125μm,一年魚之病魚,直徑約40~140μm。而發育到某種大小之多核球狀體,屬於前發芽期,為發芽之準備期間,由於核數的增功,細胞質的增量與細胞體的質變化,接著原生質分離到形成偽足狀突起,並且原生質膜從原來的細胞壁內面分離,同時原生質膜表面分泌新的薄細胞壁,使細胞壁顯著肥厚(E)。然後細胞體開始突破原來的細胞壁形成發芽狀態;發芽的細胞體在原生質膜周圍分泌薄細胞壁而連續的伸長,有時也分枝成為無隔的不規則粗細的菌絲體樣絲狀體(F),而絲狀體伸長,同時細胞體亦伴隨在絲狀體內移動,使球體形成中空階段。而絲狀體內的細胞體分裂,通常含有2~10個核,形成被薄細胞壁包圍的絲狀體孢子(G);這些絲狀體內的孢子,因絲狀體前端的破裂或絲狀體全體崩潰釋放出絲狀體內的孢子(H)。D-H′:為早期感染在胃壁內的發育生活史,其發育狀態類似於前上述生活史。
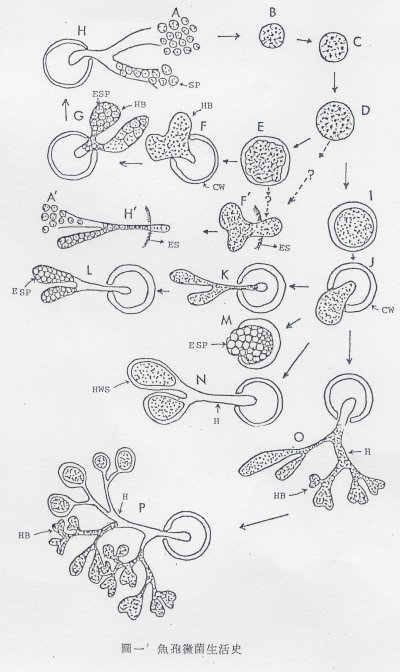 (摘自Chien, 1979) (摘自Chien, 1979)
疾病型態及流行病學
本病為全球分佈性疾病(歐洲特別是北歐國家、美洲、日本);臨床上呈慢性肉芽腫性炎症反應,如加上環境(如水溫)及生理因子(如循環中荷爾蒙,包括corticosteroids、heat-shock proteins能抑制宿主細胞免疫),則使原本為不顯性感染之罹病魚體,使疾病更為明顯呈現病變;本病原感染的水域甚為廣泛,能感染海水、淡水及丰淡鹼水養殖或野生魚類,尤其是鮭科魚類(salmonids),本病原對鮭科魚類的侵害甚為重要,一般呈現嚴重侵害罹病魚體於心臟、骨骼肌、肝、腎、脾,常呈現白色結節樣病灶於上述各器官實質組織內,而更嚴重感染甚可使病灶擴展至腦及中樞神經系統;除鮭科魚類外,尚有報告擬胎鏘屬魚類被本病原感染(topminnows; Poecilionsis)亦可形成中樞神經系統病灶。此外,依Rand氏(1990、1994, R)報告魚孢黴菌還可感染板鰓魚類(elasmobranch fishes)、海水及淡水甲殼類、兩棲類、爬蟲類及嗜魚性水鳥類(piscivorous birds);而在東北太平洋區(eastern north Pacific region)內之水牛杜父魚(buffalo sculpin, Enophrys bison)可能為帶原體,而在此區域內被感染的魚類如太平洋鱸魚(Pacific Ocean perch, Sebaster alutus)、黃尾岩礁魚(yellowtail rockfish, S. flavidus)、金絲雀岩礁魚(canary rockfish, S.pinniger)、黃口岩礁魚(yellowmouth rockfish, S. reedi)、長角杜父魚(longhorn sculpin, Myoxocephalus octodecemspinosus)、斑點沙樣錐齒碟(speckled sand dab, Cithanichthys Stigmaeus)、雄鱈魚(tom cod, Microgaus proximus)、浮浪胡瓜魚(surf smelt, Hypomesus pretiosus)及太平洋鯡魚(Pacific herring, Clupea pallasi)(Olson, 1986; kent et al., 2001; Hershberger et al., 2002)。而McVicar(1999; R)報導野生魚類如大西洋鯡魚(Atlantic herring, Clupea harengus)、大肚鯡(alewife, Alosa pseudoharengus)、大西洋鯖魚(Atlantic mackerel, Scomber scbmbrus)及黃尾鮃鰈(yellowtail flounder, Pleuronectes ferrugineus)被魚孢黴菌感染。
雖然呈系統致死性感染,但病變效應之變異則存在於分離株與不同宿主間之反應,就魚孢黴菌的致病性而言,McVicar(1999, R)報導依地域、感染宿主及菌株上的差異呈現不同的病狀,如實驗接種從太平洋分離之魚孢黴菌菌株感染太平洋鯡魚(Pacific herring, C. pallasi V.)造成80%死亡率,而接種魚孢黴菌大西洋分離株則無死亡率產生。
臨床症狀及病理學
被魚孢黴菌感染的魚體一般外觀上,並無明顯的特徵病變,但魚體會逐漸消瘦及體表顏色改變、或有時亦可觀察到某些罹病魚體呈現腹部膨脹、眼球突出及脊柱彎曲等症狀。而於魚體解剖時,輕症魚體一般無法觀察到明顯的病狀,唯重症感染魚,可發現全身臟器,隨感染階段的不同,有少許或重多的白色突起結節;其結節的分布,一般臟器包括:肝、脾、腎、心、消化道較為常見。而肌肉、胰臟及鰓則次之,當魚孢黴菌侵襲神經系統,則罹病魚體失去平衡,形成搖晃游動;侵染肝臟,則造成肝腫大,比正常魚大約1.5~2.5倍;入侵腎臟,造成腎臟腫大,如侵襲生殖腺,則罹病魚體會失去生殖能力;大量寄生皮膚,使皮膚呈現樣砂紙樣粗糙。組織病理學檢查,隨病灶的輕重,則含有各種不同期的病原體,生長期之多核球狀體具多數的核;外圍繞以單層之薄細胞壁,或萌芽前期之多核球狀體則孢體大且細胞壁增厚;而後期不僅有細胞膜的形成,並已出現偽足樣突起;菌絲形成期則見有菌絲體的產生;而增殖期之菌絲體之特徵為內含大量的內孢子,每個內孢子具有一個至數個核而稱為單核或雙核或多核球狀體,可藉由菌絲體尖端釋放孢子而散佈至其周圍組織。這些病原體外圍均環繞單層或多層之類上皮細胞,形成典型的肉芽腫性炎症反應。組織被病原體及增生的結締組織取代,當病灶擴大時,病灶中心呈現壞死病變。
病原致病性意義
魚孢黴菌目前的分類尚待確認,而水產動物所感染的病原,行專性細胞內寄生於鮭科魚類,今有三種在分類上爭議甚多之病原,屬真菌或原蟲,當無法解謎之rosette agent有Dermocystidium、Ichthyophorus、Psorospermium,從形態學的觀察準則及族緣18S SSU rDNA基因序列分析,近年來多數學者的研究,Spanggaard等氏(1996)認為屬於領鞭毛蟲類(Choanaflagellates),隨後Ragan等氏(1998)從更多資料的分析,則推翻前者之論點,認為因歸屬於Mesomycetozoea綱,同時本病原之粒線體在電子顯微觀察下呈管狀嵴構造(tubular cristae)而Dermocystidium及Psorospermium粒線體呈扁平嵴(flat cristae)構造。在西北大西洋海域從1898至1950年中期相關於魚孢黴菌呈地方性流行感染於大西洋鯡魚(Atlantic herring, Clupea harengus)甚為嚴重;並從1990年早期在瑞典與丹麥間海域估計有3億尾之大西洋鯡魚死於相關魚孢黴菌的感染,近年來(2004)報導在阿拉斯肯河(Alaskan rivers)之Chinook salmon(Oncorhynchus tshawytscha. W.)及英屬哥倫比亞之sockeye salmon(O. nerda. W.)均遭受魚孢黴菌的侵襲,造成嚴重的病害。因為chinook salmon以鯡魚為天然生物餌料,而鯡魚以海洋甲殼類為天然餌料;所以如海洋甲殼類被魚孢黴菌感染,則整個與食物鏈相關的魚類均會被魚孢黴菌侵染,造成有關魚類的死亡。
魚孢黴菌最常侵染鮭科魚類,可造成體內各臟器實質組織呈現白色結節樣病灶,而主要感染器官以心臟為主;當本病原侵染心臟組織在感染後期會有大量的大孢子(100-200μm)寄生造成心肌病變,而使心臟體重增加(增加原因為病灶內含有魚孢黴菌孢子、炎症細胞侵潤、纖維組織增加),加速心肌搏動、消耗氧氣;最後因心衰竭使魚體精力耗盡而死亡。因為同屬一海洋地域、但經不同宿主感染,所以在同樣為魚孢黴菌,而基因型卻有2個單型(haplotype),代表著對不同宿主的致病性呈現差異性的病變。
|
|
診斷方法:
|
一級初步診斷:
罹病幼魚除體色改變外,輕症者不顯出外部症狀,嚴重病例,經瀕死魚體剖檢可見肝臟、脾、腎、心臟及肌肉等臟器呈現散發或集中性白點狀結節病灶;罹病成魚一般顯見體色變黑、腹部膨脹、眼球突出、脊椎彎曲,大多內臟實質組織且散發或密發白點狀結節病變;皮膚被大量病原寄生時,呈現密布白點;當寄生於生殖腺時,則使魚體失去生殖能力;更進病情發展感染神經系統,將導致魚體失去平衡,於水中翻滾游動;病灶隨菌體寄生、增殖使得被寄生的臟器實質組織產生炎症反應及壞死病變。由發病魚體之鰓部組織,剪下少許鰓絲,行壓片鏡檢,於鰓絲上皮細胞內寄生本病原之合孢體即可初步判定魚孢黴菌感染。
二級初步診斷:
取罹病魚體病灶處少許組織接種於TGC或(thioglycollate medium)或MEM (Eagle’s minimum essential medium)液體培養基(加入10%牛胎兒血清);在14℃下孵育觀察30天。
在PH 3-5時,呈重覆分枝狀菌絲體,而提高PH 7-9時,則呈具運動性阿米色樣形狀(motile amoeba-like forms)。
三級初步診斷:目前尚無可應用的方法
一級確定診斷:
最明顯病變於罹病瀕死魚體,經剖檢可見諸多臟器實質組織呈散發或密發白點狀結節病灶,取白點結節病灶經壓片鏡檢可見本病原之合孢體(多形核球狀體或稱休止孢子,resting spore)。
二級確定診斷:
本病原屬真菌或原蟲至今尚未確立,各有學者之專論,目前較支持Mesomycetozoea綱,至少有3種魚孢黴菌的報導,Ichthyphonus gastrophilum為I. hoferi之同義病原,而I. inestinalis及I. lotae則屬蟲徽目(Enthomophthorales)、真菌界(Kindom fungi)。依Criscione et al.(2002)之報導,魚孢黴菌(Ichthyphonus hoferi)具有2個單型(haplotypes);依地理同域性,但感染不同宿主所呈現的差異性病變,一種分離株來自岩礁魚類(rockfishes),另外一種則為太平洋鯡魚及鮭魚之分離株。
本病原在電子顯微鏡觀察下,多形核球狀體之膜具有由多數微原纖維(microfibrils)平行排列所組成的厚壁,在大孢子狀況下由原纖維組成(fibrillar organization)內層,而外層邊緣則較少原纖維組成,孢子壁則呈明顯Tiery陽性反應,這種反應由內層至外層逐漸呈梯度性下降。孢壁的厚度隨孢子的大小及年齡而定,年輕孢子壁薄且無原纖維組成,僅有細小顆粒物質;這些無原纖維組成之某些小孢子呈Thiery陽性反應、亦可觀察到某些水泡構造靠近孢壁。而粒線體則呈管狀水泡樣嵴(tubulovesicular cristae)構造,並呈雙膜結構;內質由細小顆粒物質組成,含核醣體、緻密緊紮型β-肝醣顆粒、橢圓形緻密體,某些空泡聚集成水泡,內質網位於核周邊區,dictysome則可觀察於核鄰近處。有些小孢子(4~4.5μm)經常位於細胞內,而小孢子的內質性基質呈緻密紮緊含核醣體、孢壁含細小顆粒物質。
孢子萌發(germination)時,經由孢壁內質突出某些核及緻密體呈現在新菌絲體內,每個孢子之核數目隨著孢子的生長而增加,每個核含有位於中央的核仁,有時可觀察到梭狀極體(Spindle polar body)或核伴隨性胞器(nucleus-associated organelle)。
三級確定診斷:
Criscione et al.(2002)應用病原SSU rDNA基因序列A區及B區各設計出一套primers
forward primer G01:5′-CAC-CTG-GTT-GAT-CCT-GCC-AG-3′
reverse ICH2R:5′-CGA-CCA-GTA-AGC-AAT-TTC-CA--3′
增幅放大A區,估計640 bp(排除primers)
ICH1F:5′-TGG-AAA-TTG-CTT-ACT-GGT-CG-3′
ICH4R:5′-TGT-AAC-TAT-TTA-GTA-GGT-TAA--3′
增幅放大B區,估計697 bp(排除Primers)
由病原魚孢黴菌之SSU rDNA基因序列所設計之primer取決於G01位於bp1-21,1CH 2R位於bp 661-642,ICH1F位於642-661 bp、ICH4R位於1335-1355 bp,將A區及B區增幅所得之產物各為640及673 bp經定序比對,來確立魚孢黴菌的定位。
可參閱Criscione et al. 2002 ; J. Fish Dis. 25:575-582及Whipps et al. 2006; Dis. Aquat. Org. 68(2):141-147.之文獻上記載步驟操作。
|
|
治療方法:
|
目前本病尚無有效的治療方法。
|
|
預防控制方法:
|
1.不要使用疑似有魚孢黴菌污染的生魚當為餌料,其生餌必項經過蒸熟後方可餵食。
2.發病或死亡魚體必須全部撈取,掩埋或燒毀,減少傳播病原的煤介。
3.曾經發病的魚池,必須於清池後,徹底進行整理池土、曝曬及消毒等工作。
4.在購買魚苗進入飼養魚池前,必須確立先前魚苗場的疫情狀況,應確定無魚孢黴菌的感染,方可購買飼養。
|
|
相關圖片:
|
|
|
參考文獻:
|
1.Chien, C, H., Miyazaki, T., Kubota, S. (1979a). Studies on Ichthyophonus disease of fishes. V. Culture Bull. Fac. Fish. Mie Univ. 6: 161-172 (in Japanese, English summary and plate legends)
2. Chien, C, H., Miyazaki, T., Kubota, S. (1979b). Studies on Ichthyophonus disease of fishes. VII. Morphology and life cycle. Bull. Fac. Fish. Mie Univ. 6: 161-172 (in Japanese, English summary and plate legends)
3.Criscione CD, Watral V, et al. Ribosomal DNA sequenes indicated isolated populations of Ichthyophonus hoferi in geographic sympatry in the north-eastern Pacific Ocean. J. Fish Dis. 2002; 25:575-582.
4.Mendoza L, Taylor JW, Ajello L. The Class Mesomycetozoea: A heterogeneous group of microorganisms at the Animal-Fungal boundary. Annu. Rev. Microbiol. 2002; 56:315-344.
5.Rand TG, White K, Cannone JJ, et al. Ichthyophonus irregularis sp. nov. from the yellowtail flounder Limanda ferruginea from the Nova Scotia shelf. Dis Aquat. Org. 2002; 41:31-36.
6.Raffel TR, Dillard JR, Hudson PJ. Field evidence for leech-borne transmission of amphibian Ichthyphonus sp. J. Parasitol. 2006; 92(6):1256-1264.
7.Franco-Sierra A, Alvarez-Pellitero P. The morphology of Ichthyophonus sp. in their mugilid hosts ( Pisces: Teleostei ) and following cultivation in vitro. A light and electron microscopy study. Parasitol Res. 1999; 85:562-575.
8.Whipps CM, Burton T, et al. Assessing the accuracy of a polymerare chain reaction test for Ichthyophonus hoferi Yukon River Chinood Salmon Oncorhynchus tshawytscha. Dis Aquat. Org. 2006; 68(2):141-147.
9.Kocan R, Lapatra S, et al. Ichthyophonus-induced cardiac damage: a mechanism for reduced swimming stamina in salmonids. J. Fish Dis. 2006; 29:521-527.
10.Spanggaard B, Skouboe P, Rossen L, Tayolr JW. Phylogenetic relationships of the intercellular fish pathogen Ichthyophonus hoferi and fungi, choanoflagellates and the rosette agent. Marine Biology; 1996; 126:109-115.
11.Spanggaard B, Huss H, Bresciani J. Morphology of Ichthyophonus hoferi assessed by light and scanning electromicroscopy. J. Fish Dis. 2006; 18(6):567-577.
12.Torgersen T, Karlsbakk E, Kaartvedt S. Deviating vertical distribution and increased conspicuousness of parasitized Calanus. Limnol. Oecanogr. 2002; 47(4):1187-1191.
|
|
參考連結:
|
|
|
檔案下載:
|
|